YENKA
INTRODUCCIÓN
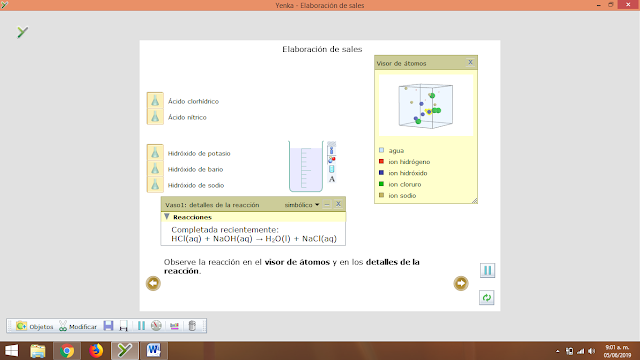
El presente trabajo práctico tiene por finalidad, aprender mediante práctica la elaboración de sales, utilizando compuestos químicos adecuados. Se puede considerar que las sales son el resultado de una neutralización al combinarse un ácido con una base, eliminándose el agua. Se entiende por neutralización la doble descomposición que tiene lugar entre un ácido y una base o hidróxido de donde se obtiene una sal y agua.Esta reacción es muy importante dentro de la química ya que nos conduce a la formación de una solución salina.Dicha reacción se puede representar por una ecuación global, indicando el ácido y la base que reaccionan sin indicar los disolventes empleados, o bien se puede representar por una o varias ecuaciones iónicas en las cuales se indica el disolvente o disolventes empleados.
OBJETIVOS
- Identificar como se forman las sales.
- Reconocer las características de las diferentes sales fabricadas.
- Identificar que materiales y/o reactivos son necesarios para la preparación de sales.
- Según la practica concluir generalidades entre las sales obtenidas.
MARCO TEÓRICO
En química, una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa). Son el producto típico de una reacción química entre una base y un ácido, la base proporciona el catión y el ácido el anión. La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidróxido (base) origina una sal más agua.
- Una base y un ácido, por ejemplo, NH3 + HCl → NH4Cl
- Un metal y un ácido, por ejemplo, Mg + H2SO4 → MgSO4 + H2
- Un metal y un no metal, por ejemplo, Ca + Cl2 → CaCl2
- Una base y un anhídrido de ácido, por ejemplo, 2 NaOH + Cl2O → 2 NaClO + H2O
- Un ácido y una base anhídrido, por ejemplo, 2 HNO3 + Na2O → 2 NaNO3 + H2O
Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión. Hay que distinguir entre distintos casos:
- En las sales de hidrácidos, se sustituye la terminación -hídrico del hidrácido del que proviene el anión para la terminación -uro. Por ejemplo, NaCl es el cloruro de sodio; el anión Cl- proviene del hidrácido HCl (ácido clorhídrico).
- En las sales de oxoácidos, se sustituye la terminación -oso o-ico del oxoácido del cual proviene el anión por la correspondiente - ito o -ato. Por ejemplo, el Ca3(PO4)2 es el fosfato de calcio; el anión PO43- proviene del H3PO4 (ácido fosfórico).H+OH-
- Las sales ácidas (sales que provienen de ácidos polipróticos y que contienen átomos de hidrógeno sustituibles) se denominan indicando el número de hidrógenos no sustituidos que quedan en la molécula, usando el prefijo correspondiente. Por ejemplo, el NaHS es la hidrogenosulfuro de sodio; el anión HS- proviene del ácido sulfhídrico.
- Las sales básicas (sales que contienen iones hidroxilo, OH-) se nombran indicando el número de hidroxilos seguido del anión central y finalmente el catión. Por ejemplo, el MgCl (OH) es el hidroxicloruro de magnesio.
- Las sales hidratadas (que contienen agua de cristalización) se denominan indicando la sal correspondiente y seguidamente el número de moléculas de agua de hidratación.
- Elaboración de sales
2. Reacciones en equilibrio
JUEGO BALANCEO DE ECUACIONES QUÍMICAS
INTRODUCCIÓN
El objetivo de balancear una ecuación química es hacer que cumpla con la Ley de la conservación de la masa la cual establece que en una reacción química la masa de los reactivos debe ser igual a la masa de los productos. Para manifestar un cambio en la materia, se utiliza una ecuación química que es la forma de representar cómo se altera la naturaleza de los elementos o cómo reacciona uno al contacto con otros. Si deseamos comprender estas alteraciones, debemos ser capaces deequilibrar o balancear las ecuaciones químicas.
OBJETIVOS
- Presentar cómo se balancea una ecuación química
- Plantear todo aquello que abarca la estequiometria, con teoría y práctica, permitiendo así que cualquier persona tenga acceso a información veraz y concreta mediante la cual pueda comprender y analizar este tema con mayor facilidad.
MARCO TEÓRICO
Las ecuaciones químicas son el modo de representar a las reacciones químicas.
Por ejemplo el hidrógeno gas (H2) puede reaccionar con oxígeno gas(O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
El "+" se lee como "reacciona con"
La flecha significa "produce".
Las fórmulas químicas a la izquierda de la flecha representan las sustancias de partida denominadas reactivos.
A la derecha de la flecha están las formulas químicas de las sustancias producidas denominadas productos.
Los números al lado de las formulas son los coeficientes.
EJERCICIOS
NIVEL 1
1.
2.
3.
4.
5.
NIVEL 2
1.
2.
3.
4.
5.
NIVEL 3
1.
2.
3.
4.
5.
WEBGRAFIA
- https://es.slideshare.net/aeroscristh/balanceo-de-ecuaciones-qumicas-30434345
- https://es.wikipedia.org/wiki/Sal_(qu%C3%ADmica)
- https://phet.colorado.edu/es/simulation/balancing-chemical-equations






































No hay comentarios.:
Publicar un comentario